La termodinámica es la ciencia que explica y determina cuanta energía se puede extraer y con qué eficiencia. Ella se ocupa de la energía y sus transformaciones en los sistemas desde un punto de vista macroscópico. Sus leyes son restricciones generales que la naturaleza impone en todas esas transformaciones.
La termodinámica es una teoría de una gran generalidad, aplicable a sistemas de estructura muy elaborada con todas las formas de propiedades mecánicas, eléctricas y térmicas complejas. Puesto que la termodinámica pone énfasis en las propiedades térmicas, es conveniente idealizar y simplificar las propiedades mecánicas y eléctricas de los sistemas que estudiaremos. En nuestro estudio de la termodinámica idealizaremos nuestros sistemas para que sus propiedades mecánicas y eléctricas sean lo más triviales posibles. Cuando el contenido esencial de la termodinámica haya sido desarrollado, será una cuestión simple extender el análisis a sistemas con estructuras mecánicas y eléctricas relativamente complejas.
La cuestión esencial es señalar que las restricciones en los tipos de sistemas considerados no son limitaciones básicas sobre la generalidad de la teoría termodinámica, y sólo se adoptan meramente para la simplificación expositiva. Restringiremos (temporalmente) nuestra atención a sistemas simples, definidos como sistemas que son macroscópicamente homogéneos, isotrópicos, y desprovistos de carga eléctrica, que son lo suficientemente grandes para que los efectos de frontera puedan ser ignorados, y que no se encuentran bajo la acción de campos eléctricos, magnéticos o gravitacionales.
En casi todos los eventos de la vida cotidiana es posible encontrar aplicaciones de la termodinámica. Los chips o circuitos electrónicos que encontramos en los computadores, celulares, cámaras de videos, etc., se han reducido de tamaño cada vez más, debido a que los ingenieros y técnicos han aplicado los principios de la termodinámica y la transmisión del calor para enfriar tales circuitos. Finalmente, si se quiere evaluar realmente los efectos de la contaminación ambiental, es necesario comprender los fundamentos de la termodinámica.
Conceptos y definiciones fundamentales
Definición de sistema, entorno y universo
Un sistema puede ser cualquier objeto, cualquier cantidad de materia, cualquier región del espacio, etc., seleccionado para estudiarlo y aislarlo (mentalmente) de todo lo demás, lo cual se convierte entonces en el entorno o alrederores del sistema.
El sistema y su entorno forman el universo.
La envoltura imaginaria que encierra un sistema y lo separa de sus inmediaciones (entorno) se llama frontera del sistema y puede pensarse que tiene propiedades especiales que sirven para:
a) aislar el sistema de su entorno o para b) permitir la interacción de un modo específico entre el sistema y su ambiente.
Llamamos sistema, o medio interior, la porción del espacio limitado por una superficie real o ficticia, donde se sitúa la materia estudiada. El resto del universo es el medio exterior.
La distinción entre sistema y entorno es arbitraria: el sistema es lo que el observador ha escogido para estudiar.
Si la frontera permite la interacción entre el sistema y su entorno, tal interacción se realiza a través de los canales existentes en la frontera. Los canales pueden ser inespecíficos para interacciones fundamentales tales como el calor o la interacción mecánica o eléctrica, o muy específicos para interacciones de transporte.
Sistemas aislados, cerrados y abiertos
Sistema aislado: Un sistema cuyas fronteras evitan la transferencia de masa, transferencia de calor y trabajo. Esto es, la cantidad de masa y energía de un sistema aislado permanece igual (el sistema que no puede intercambiar materia ni energía con su entorno).
Sistema cerrado: Un sistema cuyas fronteras permiten la transferencia de calor y el trabajo, pero no la transferencia de masa. Esto es, la cantidad de masa de un sistema cerrado siempre permanece igual, pero la cantidad de energía puede cambiar (el sistema que sólo puede intercambiar energía con su entorno, pero no materia).
Sistema abierto: Un sistema cuyas fronteras permiten transferencia de masa, transferencia de calor y trabajo. Esto es, la cantidad de masa y energía en un sistema abierto puede cambiar (el sistema que puede intercambiar materia y energía con su entorno).
Propiedades microscópicas y macroscópicas de un sistema
Todo sistema posee una estructura microscópica (moléculas, ellas mismas formadas por átomos, ellos mismos formados por partículas elementales); de modo que uno puede considerar, a priori, las características microscópicas, propias de cada una de las partículas constitutivas del sistema, y las características macroscópicas correspondientes al comportamiento estadístico de estas partículas.
Propiedades extensivas e intensivas
Para describir y analizar un sistema se debe conocer algunas de sus cantidades características. Esas cantidades se llaman propiedades, por ejemplo: volumen, masa, peso, presión, temperatura, densidad, forma, posición en el espacio, velocidad, energía, calor específico, color, sabor, olor, etc. Tales propiedades, o variables de estado, se clasifican en propiedades extensivas y en propiedades intensivas. Las propiedades extensivas tienen valores que dependen de la masa o cantidad total de sistema (por ejemplo: masa, peso, energía y volumen), mientras que las propiedades intensivas no dependen de la masa o del tamaño del sistema (color, olor, sabor, velocidad, densidad, temperatura y presión). El volumen depende de la presión P y de la temperatura T, por lo que se considera una propiedad extensiva. El volumen específico (volumen por unidad de masa) y el volumen molar (volumen por mol) son propiedades cuyos valores no dependen del tamaño del sistema.
Sistema termodinámico
Un sistema termodinámico es un sistema macroscópico, es decir, un sistema cuyo detalle de sus características microscópicas (comprendida la posición y la velocidad de las partículas en cada instante) es inaccesible y donde sólo son accesibles sus características estadísticas.
Estado de un sistema y sus transformaciones
La palabra estado representa la totalidad de las propiedades macroscópicas asociadas con un sistema. Cualquier sistema que muestre un conjunto de variables identificables tiene un estado termodinámico, ya sea que esté o no en equilibrio.
Concepto de transformación: estado inicial y estado final, transformación infinitesimal
Ocurre una transformación en el sistema si, como mínimo, cambia de valor una variable de estado del sistema a lo largo del tiempo. Si el estado inicial es distinto del estado final, la transformación es abierta. Si los estados inicial y final son iguales, la transformación es cerrada. Si el estado final es muy próximo al estado inicial, la transformación es infinitesimal.
Cualquier transformación puede realizarse por muy diversas maneras. El interés de la termodinámica se centra en los estados inicial y final de las transformaciones, independientemente del camino seguido. Eso es posible gracias a las funciones de estado.
Transformaciones reversibles e irreversibles
Una transformación es reversible si se realiza mediante una sucesión de estados de equilibrio del sistema con su entorno y es posible devolver al sistema y su entorno al estado inicial por el mismo camino. Reversibilidad y equilibrio son, por tanto, equivalentes. Si una transformación no cumple estas condiciones se llama irreversible. En la realidad, las transformaciones reversibles no existen.
Las propiedades termodinámicas de un sistema vienen dadas por los atributos físicos macroscópicos observables del sistema, mediante la observación directa o mediante algún instrumento de medida.
Un sistema está en equilibrio termodinámico cuando no se observa ningún cambio en sus propiedades termodinámicas a lo largo del tiempo.
Los estados de equilibrio son, por definición, estados independientes del tiempo.
El estado de equilibrio termodinámico se caracteriza por la anulación por compensación de flujos de intercambio y la homogeneidad espacial de los parámetros que caracterizan el sistema que ya no dependen del tiempo.
Un estado de no equilibrio es un estado con intercambios netos de masa o energía y sus parámetros característicos dependen en general de la posición y del tiempo. Si no dependen de este último, necesitan la intervención del entorno para mantener sus valores (estado estacionario fuera del equilibrio).
Reversibilidad
Un proceso es reversible si su dirección puede invertirse en cualquier punto mediante un cambio infinitesimal en las condiciones externas. Para los procesos reversibles es posible basar los cálculos en las propiedades del sistema (con independencia de los del entorno). En los procesos reversibles, el sistema nunca se desplaza más que diferencialmente de su equilibrio interno o de su equilibrio con su entorno.
Otros conceptos
Materia: Cualquier cosa que ocupe un espacio.
Sistema: Materia que es el sujeto de un análisis termodinámico. Toda región en el espacio que ocupa un volumen y tiene una frontera real o imaginaria.
Equilibrio mecánico: Condición que se alcanza cuando todas las partículas que forman un sistema están en reposo y su energía potencial total es mínima.
Equilibrio térmico: condición que resulta de la ausencia completa de gradientes de temperatura en un sistema.
Equilibrio químico: aquel que se obtiene cuando no se observa una reacción química entre los reactantes (la velocidad de reacción para formar productos iguala a la velocidad de reacción con que los productos se descomponen en las sustancias reactantes).
Equilibrio termodinámico: se produce cuando un sistema se encuentra simultáneamente en equilibrio mecánico, químico y térmico.
El concepto de estado:
Si se conociera la masa, velocidades, posiciones y todas las formas de movimiento de las partículas constituyentes de un sistema sería posible describir el estado microscópico de dicho sistema. Si no se cuenta con tal información se deberá estudiar las propiedades del sistema que describen su estado macroscópico o termodinámico. El equilibrio termodinámico se produce cuando las propiedades del sistema (presión, temperatura, volumen, concentración) son homogéneas y no cambian con el tiempo.
El estado termodinámico de un sistema simple se determina sólo cuando se conocen dos variables independientes (fijas).
Así, por ejemplo, cuando se fija P y T, el estado del sistema queda determinado, y todas las otras propiedades tienen un valor único que corresponden a ese estado. Si se considera el volumen V de un sistema como la propiedad cuyo valor depende de P y de T, entonces:
V = V(P,T). La relación matemática entre V, P y T para un sistema dado se llama ecuación de estado y puede representarse en un diagrama tridimensional, tal como se muestra en la siguiente figura:
Si se fijan 2 dos variables cualesquiera, la 3era queda determinada. Considere un proceso que se mueve desde el estado 1 al estado 2 y que hace que el cambio de volumen del gas esté dado por:
Δ V = V2 - V1
Tal proceso podría realizarse a través de un número infinito de trayectorias sobre la superficie P – V – T, dos de las cuales son:
Trayectoria 1 → a → 2
Δ V = V2 – V1 = (Va – V1) + (V2 – Va)
1 → a es un proceso isobárico (la presión se mantiene constante en P1).
a → 2 es un proceso isotérmico (la temperatura se mantiene constante en T2 ).
Trayectoria: 1 → b → 2
Las ecuaciones (1) y (2) son idénticas y representan físicamente lo que se obtiene con la diferencial total:
El cambio de volumen al moverse el gas desde el estado 1 al estado 2 depende solamente del volumen en el estado 1 y del volumen en el estado 2 y es independiente de la trayectoria tomada entre 1 y 2, razón por la cual el volumen V de un gas es una función de estado.
Un proceso es reversible si puede cambiarse su dirección en cualquier punto mediante un cambio infinitesimal en las condiciones externas. Una transformación es reversible si se realiza mediante continuos estados de equilibrio del sistema con su entorno y es posible devolver al sistema y su entorno al estado inicial a través del mismo camino. Existe entonces una equivalencia entre reversibilidad y equilibrio. Una transformación es irreversible cuando no cumple las condiciones anteriormente descritas.
Equilibrio Simple
Un sistema está en equilibrio cuando se encuentra en la superficie P-V-T del espacio tridimensional; es decir, para valores dados de presión y de temperatura el sistema está en equilibrio cuando tiene un volumen que corresponde a los valores dados de presión y de temperatura. Suponga una cantidad fija de gas contenida en un cilindro, con un pistón que puede subir o bajar:
El sistema estará en equilibrio cuando:
1.- La presión ejercida por el gas sobre el pistón es igual a la presión ejercida por el pistón sobre el gas.
Si se fija la temperatura del gas en T1 y la presión en P1, entonces se fijara el volumen del gas en el valor V1. Si se disminuye el peso W que se encuentra sobre el pistón la presión ejercida sobre el gas disminuye al valor P2, produciendo una pérdida del balance entre la presión ejercida sobre el gas (presión externa) y la presión ejercida por el gas (presión interna), haciendo que el pistón suba. Esto hace que el volumen aumente (de V1 a V2) y la presión disminuya hasta que se restablezca el equilibrio entre presiones.
Termodinámicamente el sistema cambia desde el estado 1 al estado 2, donde el volumen, que es la variable dependiente, cambia de V1 a V2:
Es decir, a T = cte. (P1, T1) → (P2, T1) ⇒ V1 → V2
Si la presión ejercida sobre el gas se mantiene constante en P2 y si la temperatura de los alrededores aumenta de T1 a T2, el gradiente térmico a través de las paredes del cilindro hace que se produzca un flujo de calor desde los alrededores hacia el interior del cilindro, haciendo que el gas se expanda hasta el volumen V3. Nuevamente, termodinámicamente el sistema cambia desde el estado 2 (P2, V2, T1) al estado 3 (P2, V3, T2). Como el volumen es una función de estado, el volumen final V3 es independiente del orden en el cual se realizaron los procesos anteriores (primero cambio a temperatura constante seguido de un proceso a presión constante, o al revés).





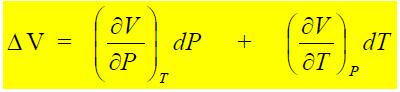

Maravilloso. Me encanta la verga.
ResponderEliminar